Hace unos días publiqué un post que me dejó muy satisfecho. Me refiero a “La concentración micelar crítica…esa gran desconocida”, una entrada que no tuvo muchas visitas pero que me aportó muchas cosas, entre ellas un gran debate en los comentarios. En aquella entrada les conté en qué consistía la concentración micelar crítica (CMC) de un ácido graso, de qué forma calcularla y cómo podía influir en las propiedades de un compuesto.
Pues bien, el debate al que me refiero giró entorno a si un pequeño cambio en la CMC (concentración de ácido graso a la cual éste pasa de forma monomérica a forma micelar) podía, o no, tener efectos muy grandes en el comportamiento fisiológico, metabólico o bioquímico de una molécula. Mi postura era que un cambio en la CMC sí que puede dar lugar a cambios significativos en determinados aspectos… y algunos lectores me pidieron un ejemplo. Ahí va.
Para apoyar mi hipótesis en el post de hoy voy a emplear la rama de la bioquímica que más alegrías me ha dado, la enzimología… y como armas usaré mi enzima preferida, lipoxigenasa, y dos de sus sustratos que más me apasionan, el ácido linoleico y el resveratrol.
Lipoxigenasa fue la niña de mis ojos durante muchos años. Sobre ella hice mi tesina y parte de mi tesis. Se trata de una enzima perteneciente al grupo de las oxidorreductasas que presenta un átomo de hierro situado en su centro activo. Esta preciosidad fue una de las primeras enzimas en ser cristalizada y se encuentra tanto en mamíferos como en plantas, relacionándose con los procesos de senescencia, germinación de semillas, cicatrización de heridas, formación de tubérculos, defensa ante el ataque de patógenos, etc.
Respecto a su actividad catalítica, esta enzima es capaz de oxidar el sistema de dobles enlaces de mi ácido graso poliinsaturado preferido, el linoleico, para dar lugar a los productos primarios de la reacción, los correspondientes hidroperóxidos.
Para medir la actividad enzimática de lipoxigenasa sobre el ácido linoleico se suele usar la espectrofotometría. Concretamente se puede monitorizar la desaparición de sustrato (linoleico) a una absorbancia de 210 nm o la aparición de los productos de la reacción (hidroperóxidos) a 234 nm. Sea de una forma u otra la reacción se sigue en una región del espectro electromagnético, el ultravioleta C, en la que si queremos usar el espectrofotómetro para medir la actividad enzimática la disolución debe esta totalmente transparente… ¿y por qué hago esta especial alusión a la transparencia de la disolución? Todo a su tiempo.
Las dos fuentes vegetales más importantes de lipoxigenasa son la soja y la patata. Una de las principales diferencias entre ambas es que lipoxigenasa de soja tiene un pH óptimo de 8.5 y la procedente de patata presenta su máxima actividad catalítica a pH 6.3. A mi la soja no me gusta nada por lo que me quedo con lipoxigenasa de patata.
A pH 6.3, el favorito de lipoxigenasa de patata, la CMC del ácido linoleico es de 17 micromolar. Tal y como comenté en el anterior post desde el punto de vista físico-químico este dato implica que, por debajo de 17 micromolar, el ácido graso se encuentra en forma monomérica y, por encima de ese valor, coexisten el monómero y la micela.
Vale, muy bien, muy bonito, pero… ¿qué tiene que ver esto con la transparencia de la disolución y con la actividad enzimática? Ahí va.
Cuando se sobrepasa la CMC del ácido linoleico, sustrato de lipoxigenasa, la micela que se forma da lugar a disoluciones turbias que impiden medir espectrofotométricamente la actividad enzimática en la región de 210-234 nm.
¿Y entonces cómo podemos determinar la actividad enzimática de lipoxigenasa de patata a pH 6.3 tanto por encima como por debajo de la CMC sin que la turbidez de la micela sea un problema?
Una opción que tenemos es cambiar de técnica de medida. En lugar de usar un espectrofotómetro podemos emplear un oxígrafo. Este aparato mide el consumo de oxígeno y es perfectamente útil para medir la actividad enzimática de una oxidorreductasa como es el caso de lipoxigenasa. Además, la turbidez no interfiere ya que no es un método óptico de análisis.
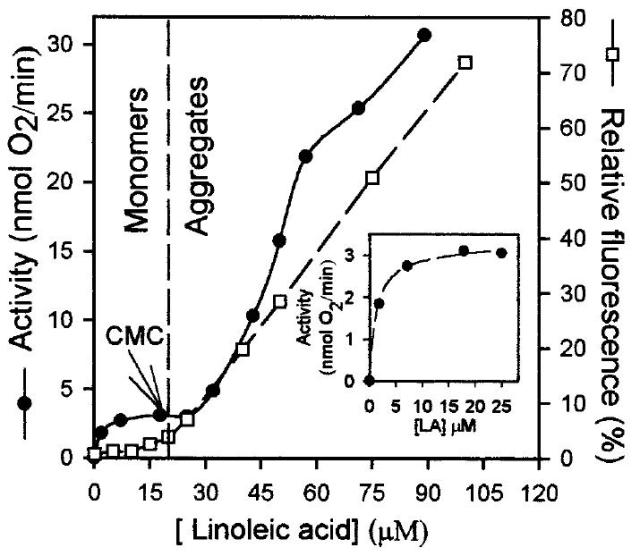
Observen detenidamente la siguiente gráfica. Es exactamente la misma que aparecía en el anterior post. En aquella ocasión solamente hice alusión al punto de intersección entre la región pre-micelar y post-micelar que define la CMC (17 micromolar) y que se correspondía con el súbito incremento de la fluorescencia que se observa en el plot definido por cuadros blancos.
Sin embargo, en esa gráfica existe otro plot. Me refiero al representado por los círculos negros. Pues bien, dicho plot corresponde a la actividad enzimática de lipoxigenasa sobre el ácido linoleico cuando este se encuentra tanto en la zona premicelar (antes de la CMC) como postmicelar (después de la CMC). Atentos a lo que se observa.
En la zona premicelar (donde solamente hay monómeros de ácido graso) la actividad enzimática presenta un comportamiento totalmente michaeliano y, al llegar a una concentración de ácido linoleico de 17 micromolar, el incremento de actividad se detiene. Sin embargo, justo en el momento en el que se traspasa la CMC la actividad enzimática no solo aumenta espectacularmente alcanzando unos niveles enormes en comparación con los que se alcanzaban en la zona monomérica, sino que lipoxigenasa sigue “catalizando a todo trapo” a concentraciones de ácido linoleico superiores a 90 micromolar sin llegarse a parar la actividad enzimática en ningún momento. Alucinante.
Este resultado demuestra como pequeñísimas variaciones en la concentración de un ácido graso pueden influir muy significativamente en una propiedad bioquímica asociada a él… en este caso la actividad enzimática de una enzima que lo oxide.
¿Podemos sacar como conclusión de todos estos datos que lipoxigenasa actúa mejor sobre las formas agregadas que sobre las monoméricas? ¡NO!
La conclusión que se puede extraer es que lipoxigenasa de patata, a pH 6.3 y 25º C, actúa mejor sobre las formas agregadas del ácido linoleico que sobre las monoméricas.
La principal diferencia entre los dos últimos párrafos es que en el primero se generaliza y eso, en bioquímica, es un tremendo error. Las enzimas son unas auténticas marquesas. Solo trabajan en “sus” condiciones óptimas de pH, temperatura, concentración de sustrato, etc. pero si les cambias esas condiciones óptimas los resultados no solo pueden cambiar sino ser totalmente diferentes… y si no me creen atentos a la parte final del post.
Otro de los sustratos de lipoxigenasa es un viejo amigo del blog, el resveratrol, una fitoalexina presente en las uvas, vino, mosto y en otros alimentos como las ostras, el cacahuete y las nueces. Estructuralmente el resveratrol es un polifenol con una estructura de dobles enlaces susceptible de ser oxidado, al igual que el ácido linoleico, por lipoxigenasa.
Pues bien, el resveratrol también presenta un comportamiento de agregación. Aunque no se ha demostrado que sea capaz de formar micelas este polifenol puede agregarse dando lugar a diferentes compuestos… y de nuevo la técnica de fluorescencia nos lo va a demostrar.
En la siguiente gráfica se puede observar como el espectro de excitación del resveratrol sufre un desplazamiento de longitud de onda máxima según la concentración empleada de dicho polifenol. Esto indica que existe un fenómeno de modificación de la estructura dependiente de su concentración.
¿Y por qué les cuento esto ahora? Fíjense ahora en la siguiente gráfica. En ella se muestra el efecto de la concentración del resveratrol sobre la actividad lipoxigenasa. En este caso elegí como fuente natural la soja y como pH 8.5. ¿Les llama algo la atención en esa gráfica? ¿Sí, verdad? Efectivamente… lipoxigenasa de soja a pH 8.5 actúa mejor sobre el resveratrol cuando éste se encuentra en forma agregada que cuando en el medio de reacción solo hay monómeros de resveratrol.
Si observan detenidamente la figura se darán cuenta de que, a concentraciones superiores a 35 micromolar (valor al cual se forman los agregados de resveratrol), la enzima lipoxigenasa de soja a pH 8.5 comienza a perder su actividad…. exactamente lo contrario que ocurría cuando el sustrato era el ácido linoleico donde se observaba un aumento de la actividad lipoxigenasa de patata a pH 6.3 al formarse los agregados.
Estimados lectores, tras 20 años dedicados a ella, la bioquímica no para de sorprenderme. Pequeñas variaciones en el origen de una misma enzima o en las condiciones físicas, químicas o estructurales de sus sustratos pueden dar lugar a que los resultados obtenidos sean los mismos, diferentes o completamente opuestos.
Sí, sé que soy un ratito emocionándome con estas cosas… pero no me digan que no es fascinante.
Jose
* ¿Me ayudas a difundir este post en MNM? Puedes hacerlo pinchando este enlace. GRACIAS.
Fuentes:
- López-Nicolás, J.M., Pérez-Gilabert, M., García-Carmona, F. J. Agric. Food Chem. 2009, 57, 4630–4635.
- López-Nicolás, J.M., Pérez-Gilabert, M., García-Carmona, F. J. Agric. Food Chem. 2008, 56, 7600–7605.
- Bru, R., López-Nicolás, Garcia-Carmona, F. Colloids ad Surfaces. Physicochemical and EngineeringAspects.97 (1995) 263-269.












¿Alguna explicación a por qué la forma agregada es más susceptible de ser atacada por los enzimas? Yo a priori habría dicho lo contrario, pero los hechos son los hechos. ¿Se sabe de que dimensiones promedio son las micelas de resveratrol?
Pingback: Lipoxigenasa… la enzima de las dos caras
Nunca dejó de admirarme cuando leo tu blog. Esta entrada es magnífica
Pingback: Resumen Scientia [Junio-Julio] | SCIENTIA
hola!! n0 manejo los terminos cientificos que usa, podría por favor decirme si consideras que el consumo de capsulas de resveratrol es bueno como antioxidante para el organismo, la piel, me lo receto mi médico para las arrugas
¿Por que se utilizan inhibidores de la lipoxigenasa y de la cicloxigenasa en el tratamiento del dolor en enferedades autoinmunes, como la ratritis psoriasica?
por favor que alguien responda a Albero Calpe porque mi duda es exactamente la misma, necesito saber por qué la Silimarina por ejemplo ejerce una acción de reducción de la actividad de los leucotrienos que tienen que ver con la replicación celular excesiva y problemas como caspa, dermatitis, psoriasis etc. No encuentro una explicación por ninguna parte que me permita entenderlo…
Entonces con esto,como es la actividad de la Lipoxigenasa de la patata en funcion del acido linoleico como sustrato y no el resveratrol?????????????????????????’
LEÍ UN POCO TARDE ESTA ENTRADA, PERO ME ENCANTÓ. SE BIEN POCO DE QUIMICA Y DE ENZIMAS, PERO TAMBIEN ESTOY ENAMORADA DE LA LIPOXIGENASA. QUIERO SABER MAS DE CÓMO ACTÚA EN EL PROCESO DE ELABORACIÓN DEL ACEITE DE OLIVA, CON EL LINOLEICO. ¿ME PUEDES AYUDAR?
Muy interesante verlo desde el punto de vista bioquímico, me gustó más que verlo desde el punto de vista cuántico 😦